产品货号:
YTB3123
中文名称:
磷酸化蛋白纯化磁珠
英文名称:
BalbMag NTA-Fe Magnetic Agarose Beads for Phosphoprotein Purification
产品规格:
1mL|5mL|20mL
发货周期:
1~3天
产品价格:
询价
本制品是一种由高质量的次氮基三乙酸(NTA)共价偶联至琼脂糖磁珠,再通过NTA的4个结合位点螯合三价铁离子(Fe3+)制备而成的琼脂糖磁珠。本制品可特异性地与动植物或者微生物裂解液、血清、腹水等样品中磷酸化蛋白结合,从而用于磷酸化蛋白或磷酸化蛋白复合物的纯化、免疫沉淀(IP)或免疫共沉淀(Co-IP)。
BalbMag磷酸化蛋白纯化琼脂糖磁珠(NTA-Fe)可特异性地结合磷酸化蛋白,并可以借助磁力架等磁分离设备非常便捷地应用于磷酸化蛋白或其蛋白复合物的纯化或免疫沉淀等实验。本制品基于固定化金属离子亲和层析(IMAC)技术研发而成。研究发现,二价金属离子如铜离子、锌离子和镍离子可用于His-tag蛋白的分离纯化,而三价铁离子和四价钛离子可用于磷酸化蛋白的富集和纯化。本制品的NTA-Fe琼脂糖磁珠能高效且快速地进行磷酸化蛋白和磷酸化多肽的富集和纯化,蛋白纯化步骤简便,纯化条件温和,且蛋白纯化后可直接进行下游实验。

- 稳定性高、特异性强、靶蛋白结合量高:与国内外大多数的同类产品相比,本制品铁离子配基密度较高,铁离子脱落程度低,对磷酸化蛋白的结合具有很强的特异性。本制品每毫升悬浊液含约25%琼脂糖磁珠沉淀,含有不少于30μmol/mL的NTA-Fe3+,通常每毫升琼脂糖磁珠沉淀可结合>12mg磷酸化蛋白,具体的最大结合量和磷酸化蛋白的分子量大小相关。
- 结合目的蛋白速度快:本制品使用了NTA螯合的铁离子,粒径在100μm左右。通常30分钟内即可完成磷酸化蛋白吸附的过程,60分钟内完成目的蛋白纯化或免疫沉淀操作。缩短操作时间可以有效避免在长时间操作过程中目的蛋白的降解或变性,充分保证目的蛋白的活性。
- 可高效洗脱磷酸化蛋白:本制品根据磷酸化蛋白的结构、生物学功能及后续应用的要求等,使用磷酸盐进行多次洗脱。洗脱时间短,洗脱效率高。
- 使用便捷:本制品储存在特殊保护液中,不含甘油,可以通过磁性吸附实现快速高效的分离,无需离心操作。

磷酸化蛋白是研究最多的一种蛋白质翻译后修饰,蛋白质的磷酸化和去磷酸化对生物体的众多生命活动起着至关重要的作用。质谱分析可精确鉴定蛋白质中发生的磷酸化修饰,并定位到具体的氨基酸残基,是磷酸化蛋白组学研究的核心技术。在进行质谱分析前,需要将蛋白质直接酶解成片段,但是这样的操作不仅增加了样品的复杂度,并且由于酶解后大量非磷酸化肽段抑制磷酸化肽段的质谱信号从而降低了磷酸化肽段的质谱检测灵敏度。因此,在质谱分析前对磷酸化蛋白或多肽进行有效的分离富集非常重要。

| 组分 | 1mL | 5mL | 20mL |
| 磷酸化蛋白纯化磁珠 | 1mL | 5mL | 20mL |
| 说明书 | 1份 | ||
保存:2~8℃,有效期1年。

本制品每毫升悬浊液中共含约0.25mL琼脂糖磁珠沉淀。本制品标注的体积为悬浊液总体积。每毫升悬浊液可以用于纯化约3mg分子量约为60kD的磷酸化蛋白。磷酸化蛋白分子量的大小会影响本制品可以纯化的目的蛋白的mg数。

| 产品含量 | 在特定保护缓冲液中的25%悬浮液 |
| 磁珠粒径 | 30~150μm |
| 磁性类型 | 超顺磁性 |
| 偶联配体 | 次氮基三乙酸(NTA) |
| 螯合金属离子 | Fe3+ |
| 金属离子密度 | >30μmol/mL磁珠 |
| 结合能力 | 每毫升磁珠(100%浓度)可结合> 12mg磷酸化蛋白 |
| 特异性 | 磷酸化蛋白、磷酸化多肽 |
| 应用领域 | 磷酸化蛋白纯化、免疫沉淀(IP)、免疫共沉淀(Co-IP) |

- 本NTA-Fe琼脂糖磁珠经测试,冻融3次不影响效价,但仍建议适当分装减少冻融次数。频繁使用建议4℃保存。
- 本制品纯化时不可以使用磷酸盐类缓冲液,以免和磷酸化蛋白形成竞争结合,从而降低磷酸化蛋白的载量。
- 本制品需维持pH为6~8,避免高速离心、干燥;请勿长时间将磁珠置于磁场中,否则可能会引起磁珠聚团。
- 本制品使用过程中,缓冲试剂如Tris、HEPES、MOPS等的浓度不宜超过100mM,Triton、Tween、NP-40的浓度不宜超过2%,脱氧胆酸钠、CHAPS的浓度不宜超过1%。其它未提及试剂的兼容性可以参考上述试剂,但有待实验验证。
- 本制品使用前要适当充分重悬,即颠倒若干次使磁珠混合均匀,混匀操作须轻柔,不宜剧烈涡旋震荡。
- 在纯化或免疫沉淀时,建议设置阳性和阴性对照组。
- 蛋白样品收集后宜尽快完成纯化工作,并应始终放置在4℃或冰浴,以减缓蛋白降解或变性。为有效抑制蛋白降解,可以在蛋白样品中添加适量的蛋白酶抑制剂混合物,但不要添加EDTA。例如通用型蛋白酶抑制剂混合物、蛋白酶和磷酸酶抑制剂混合物(质谱兼容)、哺乳动物样品专用蛋白酶抑制剂混合物、哺乳动物样品专用蛋白酶和磷酸酶抑制剂混合物等。
- 如果使用真空泵等仪器吸取上清液,须注意真空泵的吸液强度,以免吸力过大而吸取到聚集的磁珠。
- 0.1%的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可有效防止磁珠聚集,并且不会影响磁珠的抗体结合效率。
- 如果自行配制裂解液,需注意DTT、巯基乙醇和EDTA等对本制品与磷酸化蛋白的结合可能有一定影响,但Western及IP细胞裂解液(无抑制剂)或RIPA裂解液(强,无抑制剂)等都完全适用。

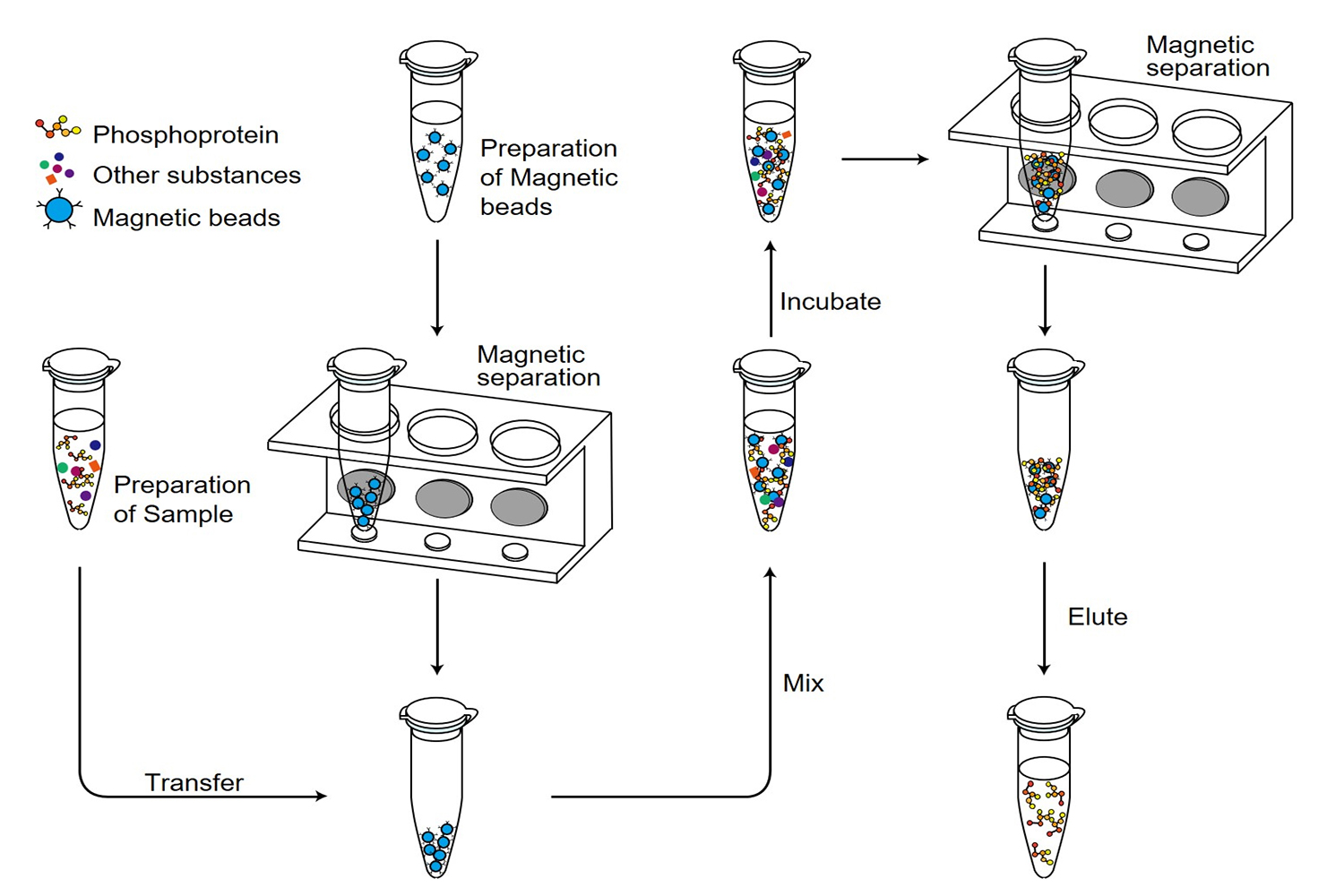
图1.磷酸化蛋白纯化磁珠工作原理与操作流程图。

本步骤以重组人表皮生长因子(EGF)诱导后的HeLa细胞裂解液为例,对于富集纯化磷酸化蛋白进行详细说明。
- 缓冲液的准备:
- Binding/Wash Buffer:50mM MES,1M NaCl,pH6.0
- Elution Buffer:50mM Na2HPO4-NaH2PO4,300mM NaCl,pH7.4
- 所用水和缓冲液在使用之前建议用0.22μm或0.45μm孔径滤膜过滤,以减少杂质,提高磷酸化蛋白纯化效率。
- 推荐的缓冲液适用于大多数磷酸化蛋白的纯化。对于特殊样品,需自行进行适当的优化或参考常见问题。
- Binding/Wash Buffer:50mM MES,1M NaCl,pH6.0
- 样品的制备:
- 选择合适的裂解液,用于制备细胞或组织的裂解液。优先推荐选择Western及IP细胞裂解液(无抑制剂)用于细胞或组织样品的裂解。根据特定的实验目的,如有必要,也可以使用RIPA裂解液(强,无抑制剂)用于样品的制备。如果使用自行配制的或其它公司生产的裂解液,需要确保裂解液的pH为6~8,确保溶液里无EDTA,无金属离子。
- 细胞裂解液中推荐在裂解细胞或组织样品加入蛋白酶和磷酸酶抑制剂混合物(质谱兼容),这样可以有效避免蛋白的降解和磷酸化蛋白的去磷酸化。请勿加入EDTA。
- 具体的细胞或组织样品裂解的制备步骤请参考裂解液的使用说明。制备好的裂解液上清宜置于冰上或4℃存放,随后即可用于免疫沉淀或免疫共沉淀、磷酸化蛋白的纯化等操作。新鲜制备好的样品,建议尽量当天完成免疫沉淀等后续操作,但如果样品不能当天使用,也可以适当分装后-80℃冻存。
- 选择合适的裂解液,用于制备细胞或组织的裂解液。优先推荐选择Western及IP细胞裂解液(无抑制剂)用于细胞或组织样品的裂解。根据特定的实验目的,如有必要,也可以使用RIPA裂解液(强,无抑制剂)用于样品的制备。如果使用自行配制的或其它公司生产的裂解液,需要确保裂解液的pH为6~8,确保溶液里无EDTA,无金属离子。
- NTA-Fe磁珠的准备:
- 用移液器轻轻吹打重悬NTA-Fe磁珠,按照每3mg目标蛋白(分子量约为60kD)需要使用1mL磁珠悬浊液的用量,取适量NTA-Fe磁珠至一洁净离心管中,磁性分离去除上清;加入与原磁珠悬浊液等体积或适当更大体积的Binding/Wash Buffer洗涤磁珠。
- 用移液器轻轻吹打重悬NTA-Fe磁珠。置于磁分离架上分离10秒,去除上清。重复上述步骤两次。
- 为了减少磁珠的损耗,待溶液澄清后,盖紧离心管盖子,保持离心管仍在磁力架上,按住离心管上下翻转数次,使澄清的溶液洗涤离心管盖子上残留的磁珠,静置后使溶液变澄清。以下同。
- 用移液器轻轻吹打重悬NTA-Fe磁珠,按照每3mg目标蛋白(分子量约为60kD)需要使用1mL磁珠悬浊液的用量,取适量NTA-Fe磁珠至一洁净离心管中,磁性分离去除上清;加入与原磁珠悬浊液等体积或适当更大体积的Binding/Wash Buffer洗涤磁珠。
- 目标蛋白与磁珠结合:
- 加入磁珠与孵育:按照每3mg目标蛋白(分子量约为60kD)样品(通常使用BCA法检测蛋白浓度),加入1mL磁珠悬浊液的比例加入NTA-Fe磁珠,置于侧摆摇床或旋转混合仪上,室温孵育30分钟。
- 如果需要,可以在2~8℃旋转混合1小时,以防止目标蛋白降解。
- 磁分离:孵育完毕后,置于磁力架上分离10秒,去除上清。
- 对于上清部分,可适量保存并用于检测纯化的效果。
- 洗涤:加入1mL的Binding/Wash Buffer,用移液器轻轻吹打重悬NTA-Fe磁珠。置于磁力架上分离10秒,去除上清。重复洗涤三次。
- 加入磁珠与孵育:按照每3mg目标蛋白(分子量约为60kD)样品(通常使用BCA法检测蛋白浓度),加入1mL磁珠悬浊液的比例加入NTA-Fe磁珠,置于侧摆摇床或旋转混合仪上,室温孵育30分钟。
- 洗脱:
- 根据目标蛋白的浓度及后续实验要求,可以加入0.2~1mL Elution Buffer,轻轻翻转离心管数次,摇床摇动洗脱5分钟,磁性分离,收集洗脱液到新的离心管,即为纯化的磷酸化蛋白。
- 如果需要,重复上述步骤2~3次,收集样品到新的离心管中,还可以得到一些磷酸化蛋白。
- 根据目标蛋白的浓度及后续实验要求,可以加入0.2~1mL Elution Buffer,轻轻翻转离心管数次,摇床摇动洗脱5分钟,磁性分离,收集洗脱液到新的离心管,即为纯化的磷酸化蛋白。
- 磁珠的清洗和再生:
- 向离心管加入1mL Elution Buffer,上下翻转离心管数次,使磁珠重悬,涡旋10秒,磁性分离,去除上清。重复3次。
- 向离心管中加入1mL 20%乙醇,上下翻转离心管数次,使磁珠重悬,涡旋10秒,磁性分离,去除上清。重复3次。
- 磁珠保存在20%乙醇中,使总体积等于初始悬浮液体积,置于4℃或-20℃保存,并可用于下一次同种蛋白的纯化。待检测的不同样品,不建议使用清洗和再生的NTA-Fe磁珠。
- 向离心管加入1mL Elution Buffer,上下翻转离心管数次,使磁珠重悬,涡旋10秒,磁性分离,去除上清。重复3次。


图2.磷酸化蛋白纯化磁珠用于EGF诱导的Hela细胞中磷酸化蛋白的纯化效果图。样品1为细胞裂解液;样品2是Flow through,即穿流液;样品3为BalbMag磷酸化蛋白纯化琼脂糖磁珠(NTA-Fe)第一次洗脱获得的样品。Western检测使用的抗体为磷酸化Erk1/Erk2抗体。实际结果会因实验条件、检测仪器等的不同而存在差异,本图仅供参考。

| 问题 | 可能原因 | 解决方案 |
| 洗脱液中磷酸化蛋白极少或不存在 | 细胞收集条件欠佳 | 收集前,用非磷酸盐缓冲液(如0.9%氯化钠溶液)清洗细胞两次。 |
| NTA-Fe磁珠未用结合缓冲液平衡 | 用5倍体积的结合缓冲液平衡NTA-Fe磁珠。 | |
| 样品未在结合缓冲液中平衡 | 在结合/洗涤缓冲液中将样品稀释至磷酸化蛋白浓度为0.25~0.5mg/mL。 | |
| 样品浓度过高 | 使用磷酸化蛋白浓度为0.25~0.5mg/mL的样品。 | |
| 样品黏度过高 | 向样品中添加DNase。 | |
| 样品与NTA-Fe磁珠混合不充分 | 确保样品在4℃摇床上充分混合30分钟。 | |
| 样品中存在螯合剂/还原剂 | 在与NTA-Fe磁珠混合前,对样品进行缓冲液置换,以去除螯合剂(如EDTA)或还原剂(如β-巯基乙醇、DTT)。 | |
| 非特异性蛋白污染 | NTA-Fe磁珠过载 | 为获得最佳效果,每毫升磁珠悬浮液中磷蛋白用量应< 3mg。 |
| 洗涤不充分 | 确保使用结合/洗涤缓冲液清洗NTA-Fe磁珠3次,总清洗体积为3mL。 | |
| 双向电泳拖尾 | 样品中存在盐分 | 在双向电泳分析前进行缓冲液置换。 |
相关搜索:磷酸化蛋白纯化磁珠,磷酸化蛋白纯化,磷酸化抗体纯化,磷酸化蛋白富集,NTA-Fe琼脂糖磁珠,NTA-Fe磷酸化蛋白纯化磁珠,NTA-Fe琼脂糖磁珠,NTA-Fe磁珠,NTA铁磁珠



